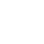化妆品分类指南
进口化妆品:是指最后一道接触内容物的(分装/罐装)工序在境外(含港澳台)完成的产品。
国产化妆品:是指最后一道接触内容物的(分装/罐装)工序在境内(中国大陆)完成的产品。
特殊用途化妆品:具体指育发类、染发类、烫发类、脱毛类、美乳类、健美类、除臭类、祛斑(含美白)类、防晒类九类产品。
非特殊用途化妆品:除上述特殊用途化妆品以外的产品。
进口非特殊化妆品备案
一、申报流程
(一) 在华申报责任备案
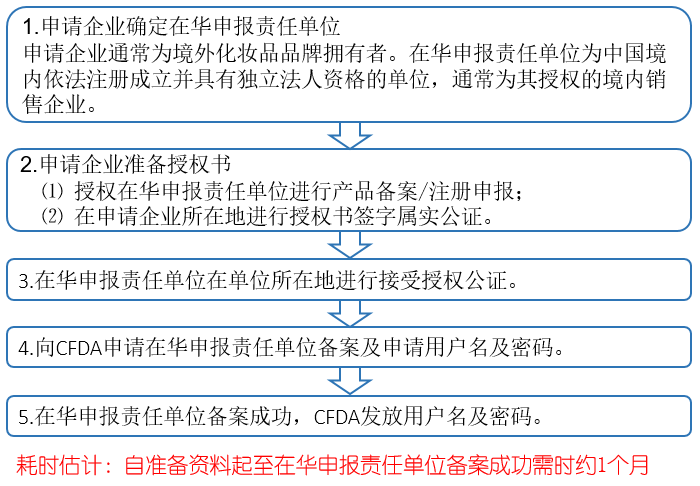
(二) 产品检测
二、申报资料清单
(一)进口非特殊用途化妆品行政许可申请表;
(二)产品中文名称命名依据;
(三)产品配方;
(四)产品质量安全控制要求;
(五)产品原包装(含产品标签、产品说明书);拟专为中国市场设计包装的,需同时提交产品设计包装(含产品标签、产品说明书);
(六)经国家食品药品监督管理总局认定的许可检验机构出具的检验报告及相关资料;
(七)产品中可能存在安全性风险物质的有关安全性评估资料;
(八)已经备案的行政许可在华申报责任单位授权书复印件及行政许可在华申报责任单位营业执照复印件并加盖公章;
(九)化妆品使用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书;
(十)产品在生产国(地区)或原产国(地区)生产和销售的证明文件;
(十一)可能有助于行政许可的其他资料;
(十二)生产工艺简述和简图;
(十三)产品技术要求的文字版和电子版。
*另附许可检验机构封样并未启封的市售样品1件。
三、申报资料主要要求
(一)申报资料的一般要求
1、提交申报资料原件1份。
2、除检验报告、公证文书、官方证明文件及第三方证明文件外,申报资料原件应由申请人逐页加盖公章或骑缝章;进口化妆品(新原料)申报资料原件还应由行政许可在华申报责任单位逐页加盖行政许可在华申报责任单位公章或骑缝章。
3、使用A4规格纸张打印,使用明显区分标志,按规定顺序排列,并装订成册。
4、使用中国法定计量单位。
5、申报内容应完整、清楚,同一项目的填写应当一致。
6、所有外文(境外地址、网址、注册商标、专利名称、SPF、PFA或PA、UVA、UVB等必须使用外文的除外)均应译为规范的中文,并将译文附在相应的外文资料前。
7、终止申报后再次申报的,还应说明终止申报及再次申报的理由;不予行政许可后再次申报的,应提交不予行政许可(变更/延续)决定书复印件,并说明再次申报的理由,同时还应提交不予行政许可原因是否涉及产品安全性的书面说明。
8、产品配方应提交文字版和电子版。
9、文字版和电子版的填写内容应当一致。
10、生产和销售证明文件、质量管理体系或良好生产规范的证明文件、不同国家的生产企业同属一个集团公司的证明、委托加工协议等证明文件可同时列明多个产品。这些产品如同时申报,一个产品使用原件,其他产品可使用复印件,并书面说明原件所在的申报产品名称;这些产品如不同时申报,一个产品使用原件,其他产品需使用经公证后的复印件,并书面说明原件所在的申报产品名称。
11、产品技术要求电子版应登录国家食品药品监督管理总局化妆品行政许可网上申报系统填写。
(二)申报资料的具体要求
1、逐项提交各项资料。
2、应按照申请表填表说明的要求填写申请表各项。
行政许可申请表保证书应由进口化妆品生产企业或进口化妆品新原料生产企业法定代表人或其授权的该生产企业的签字人或其授权的在华申报责任单位的签字人签字;无公章的,应在保证书生产企业签章处予以注明。
行政许可申请表承诺书应由行政许可在华申报责任单位法定代表人或法定代表人授权该单位的签字人签字并加盖行政许可在华申报责任单位公章。
授权委托签字时,应提供授权委托书公证件及其中文译文,并做中文译文与原文内容一致的公证。根据《资料要求》第二十四条的要求,在每次提交行政许可申请时应同时提交授权委托书原件或经公证后的复印件,并书面说明委托签字授权书原件所在的申报产品名称。授权委托签字的内容不应包含于行政许可在华申报责任单位授权书中。
3、产品配方应包括许可检验机构对进口产品配方的确认证明,其确认日期应与检验样品的受理日期一致。
4、产品质量安全控制要求应包括在原产国执行的产品质量安全控制要求(外文版及中文译文)及产品符合《化妆品卫生规范》要求的承诺。
5、因体积过小(如口红、唇膏等)而无产品说明书或将说明内容印制在产品容器上的,应在申报资料中产品包装部分提交相关说明。
6、经国家食品药品监督管理总局认定的许可检验机构出具的检验报告及相关资料应符合以下要求:
(1)许可检验机构出具的检验报告,应当包括以下资料:
1)检验申请表。
2)检验受理通知书。
3)产品使用说明。
4)卫生安全性检验报告(微生物、卫生化学、毒理学)。
5)如有以下资料应提交:
①人体安全性检验报告(如人体试用试验);
②其他新增项目检测报告(如化妆品中石棉检测报告等)。
(2)申请变更化妆品行政许可检验报告中的生产企业名称、生产企业地址、产品中文名称的,相关许可检验机构应分别出具相应的补充检验报告并说明理由。
7、产品在生产国(地区)或原产国(地区)生产和销售的证明文件,应当符合以下要求:
(1)由产品生产国(地区)或原产国(地区)政府主管部门或行业协会出具。无法提交文件原件的,可提交复印件,复印件应经出具机构或我国使(领)馆确认。
(2)应载明产品名称、生产企业名称、出具文件的机构名称并有机构印章或法定代表人(或其授权人)签名及文件出具日期。
(3)所载明的产品名称和生产企业名称应与所申报的内容完全一致;如为委托加工或其他方式生产,其证明文件所载明的生产企业与所申报的内容不一致时,应由申请人出具证明文件予以说明;必须配合使用的多剂型产品可仅提交产品进口部分的生产和销售证明文件。
(4)生产和销售证明文件如为外文,应译为规范的中文,中文译文应由中国公证机关公证。
8、申报产品属于下列情况的,除按以上规定提交资料外,还应当分别提交下列资料:
(1)申报产品以委托加工方式生产的,应提交以下资料:
1)委托方与被委托方签订的委托加工协议书。
2)进口产品应提交被委托生产企业的质量管理体系或良好生产规范的证明文件或符合生产企业所在国(地区)法规要求的化妆品生产资质证明文件。
3)境内生产企业委托境外企业生产的进口产品可不提交行政许可在华申报责任单位授权书、生产和销售的证明文件及产品原包装,应提交产品包装设计。
4)被委托生产企业的质量管理体系或良好生产规范的证明文件或符合生产企业所在国(地区)法规要求的化妆品生产资质证明文件应当符合下列要求:
①由认证机构或第三方出具或认可。无法提交原件的,可提交复印件,复印件应由中国公证机关公证或由我国使(领)馆确认。
②所载明的生产企业名称和地址应与所申报的内容完全一致。
(2)实际生产企业与化妆品生产企业(申请人)属于同一集团公司的,应提交实际生产企业与化妆品生产企业(申请人)属于同一集团公司的证明文件和企业集团公司出具的产品质量保证文件。
9、多个实际生产企业生产同一产品可以同时申报,其中一个实际生产企业生产的产品应按上述规定提交全部资料,此外,还应提交以下资料:
(1)涉及委托生产加工关系的,提交委托生产加工协议书,进口产品还应提交被委托生产企业质量管理体系或良好生产规范的证明文件或符合生产企业所在国(地区)法规要求的化妆品生产资质证明文件。
(2)生产企业属于同一集团公司的,提交生产企业属于同一集团公司的证明文件及企业集团出具的产品质量保证文件。
(3)其他实际生产企业生产产品原包装。
(4)其他实际生产企业产品的卫生学(微生物、卫生化学)检验报告。
(5)其他实际生产企业化妆品使用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书。
10、符合以下包装类型的样品应按下列规定申报:
(1)一个样品包装内有两个以上(含两个)独立小包装或能分隔的样品(如眼影、粉饼、腮红等),且以一个产品名称申报,应分别提交产品配方和检验报告;非独立包装或不能分隔的样品,应提交一份检验报告,各部分应分别提交产品配方。
(2)样品为不可拆分的组合包装,且以一个产品名称申报,其物态、原料成分不同的,应分别提交产品配方、检验报告。
(3)两剂或两剂以上必须配合使用的产品,应按一个产品申报。根据多剂型是否混合后使用的实际情况,提交混合检验报告或分别提交各自剂型的检验报告。
(4)同一生产企业申报的2个或2个以上原包装外文名称相同,但外观形态不同的进口产品,应在申请表和生产销售证明文件外文名称中增加表示产品外观形态的词语,以示区别,并附相关说明。
11、多色号系列非特殊用途化妆品,当基础配方相同,并申请抽样进行毒理检验时,可作为一组产品同时申报。每个产品申报资料中均应附上系列产品的名单、基础配方和着色剂一览表以及抽检产品名单。
12、境内企业委托境外企业生产加工的进口样品,按国产产品提交送审样品。
四、审批机构承诺时限
(一)受理:国家行政受理服务中心自收到申报资料后,5日内作出是否受理的决定。
(二)行政许可决定:国家食品药品监督管理总局应当在20日内作出审批决定;20日内不能做出决定的,可以延长10日,并出具《行政许可决定延期通知书》,将延期理由告知申请人。
(三)送达:国家食品药品监督管理总局应当自作出药品注册审批决定之日起10日内颁发、送达有关行政许可证件。
注:以上期限以工作日计算,不含法定节假日。
 En
En





 湖南长沙IFS
湖南长沙IFS